Принцип Ауфбау є основним методом, який говорить нам, як електрони заповнюються на атомній орбіталі. Згідно з принципом Ауфбау, заповнення електронів в основному стані атома відбувається за базовою схемою. Цей принцип говорить нам, що електрони на атомній орбіталі будь-якого атома заповнені в порядку зростання їх енергії, і для знаходження енергії атомної орбіталі вони дотримуються правила n+l.
Принцип будови
У цій статті ми детально дізнаємося про принцип Ауфбау, особливості принципу Ауфбау, його винятки та обмеження.
Визначення принципу структури
Принцип Ауфбау говорить про це
Електрони на різних орбіталях заповнюються в порядку зростання їхньої енергії, тобто орбіталь з найменшою енергією буде заповнена першою, а орбіталь з найбільшою енергією буде заповнена останньою.
Слово «Aufbau» німецькою мовою означає «будівництво». Утворення орбіталей означає заповнення орбіталей електронами. У ньому стверджується, що електрони на атомних орбіталях заповнюються в порядку зростання енергії атомної орбіталі. А енергія атомної орбіталі розраховується за правилом n+l, яке визначає, чи має електрон з більшим номером значення n+l вищу енергію. У правилі, розглянутому в попередньому рядку, п повідомляє головне квантове число і л повідомляє азимутальне квантове число.
Якщо два електрони мають однакове значення n+l, то електрон із меншим значенням п має меншу енергію і заповнюється першим. Порядок заповнення електронами атомної орбіталі обговорюється нижче.
Структура принципової діаграми
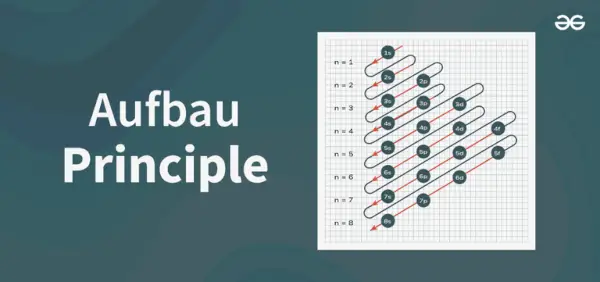
Принципова діаграма Ауфбау — це діаграма, яка зображує порядок заповнення електронами в атомі.
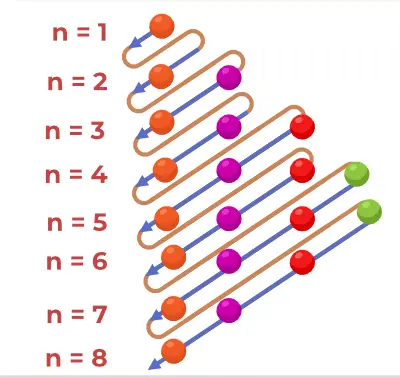
Структура принципової діаграми
Структура формули принципу
Формула принципу Ауфбау — це формула, яка визначає порядок, у якому електрони заповнюються на атомній орбіталі. Формула атомної орбіталі є
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Структура основного класу 11
Принцип Ауфбау є важливим принципом хімії для учнів 11 класу. Цей принцип стверджує, що,
Електрони на атомній орбіталі атома заповнюються в порядку зростання енергії атомної орбіталі, яка обчислюється за правилом (n+l).
Складання схеми будови
Діаграма Aufbau намальована за допомогою кроків, доданих нижче,
- Знайти кількість електронів, які мають заповнитися в атомах.
- Ми знаємо, що в атомі
- s-орбіталь може утримувати максимум 2 електрони.
- р-орбіталь може утримувати максимум 6 електронів.
- d-орбіталь може утримувати максимум 10 електронів.
- f-орбіталь може утримувати максимум 14 електронів.
- Заповніть перші два електрони на 1s-орбіталі.
- Потім дотримуйтеся правила n+l і заповніть електрони відповідно.
Основні особливості принципу структури
Різні особливості принципу Ауфбау:
- Енергія орбіталі залежить від суми значень головного квантового числа (n) і азимутального сумарного числа (I). Це називається (n + l) правило . Відповідно до цього правила,
- У нейтральному ізольованому атомі чим менше значення (n + l) для орбіталі, тим менша його енергія. Однак якщо два різних типи орбіталей мають однакове значення (n + l), то орбіталі з меншим значенням n мають меншу енергію.
| Тип орбіти | Значення n | Значення l | Значення n+l | Відносна енергія |
|---|---|---|---|---|
| 1с | 1 | 0 t тригер | 1+0 = 1 | Найнижча енергія |
| 2s | 2 | 0 | 2+0 = 2 | Вища енергія, ніж 1s орбіталь |
| 2п 3s | 2 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p-орбіталі (n=2) мають меншу енергію, ніж 3s(n=3) орбіталі. |
| 3п 4s | 3 4 | 1 0 | 3+1 = 4 4+0 = 4 | 3p-орбіталі (n=3) мають меншу енергію, ніж 4s(n=4) орбіталі. |
| 3d 4п | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d-орбіталі (n=3) мають меншу енергію, ніж 4p(n=4) орбіталі. |
З опису, наведеного в таблиці, випливає, що енергії різних орбіталей зростають зі збільшенням номера головного квантового числа.
- Таким чином, порядок, у якому електрони заповнюються на атомній орбіталі атом є, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Електронна конфігурація за принципом Ауфбау
The електронна конфігурація використання принципу Ауфбау для кількох елементів обговорюється нижче:
Електронна конфігурація сірки
Атомний номер Сульфуру дорівнює 16, тобто він має 16 електронів
Тепер, використовуючи принцип Ауфбау, електронна конфігурація Sulphur записується так:
[S] = 1 с 2 2s 2 2п 6 3s 2 3п 4
Електронна конфігурація азоту
Атомний номер азоту 7, тобто він має 7 електронів
Тепер, використовуючи принцип Ауфбау, електронна конфігурація азоту записується так:
[N] = 1 с 2 2s 2 2п 3
Винятки з принципу побудови
Є кілька винятків із принципу Ауфбау, а саме хром і мідь. Їхня електронна конфігурація така:
Електронна конфігурація Chromium
Електронна конфігурація Chromium має відповідати принципу Ауфбау
- Cr(24): [Ar]3d 4 4s 2
Але наведена вище конфігурація не є правильною, оскільки фактична електронна конфігурація Chromium(Cr) така:
- Cr(24): [Ar]3d 5 4s 1
Причиною такої електронної конфігурації є те, що наполовину заповнена d-атомна орбіталь більш стабільна ніж орбіталь, заповнена згідно з принципом Ауфбау.
Електронна конфігурація міді
Електронна конфігурація міді відповідно до принципу Ауфбау повинна бути,
- Cu(29): [Ar]3d 9 4s 2
Наведена вище конфігурація є неправильною, оскільки фактична електронна конфігурація міді (Cu) така:
- Cu(29): [Ar]3d 10 4s 1
Причиною такої електронної конфігурації є те, що повнозаповнена d-атомна орбіталь більш стабільна ніж орбіталь, заповнена згідно з принципом Ауфбау.
Детальніше
- Квантові числа
- Форма атомних орбіталей
- Будова атома
Принцип структури – поширені запитання
Що таке принцип Ауфбау в хімії?
Принцип Ауфбау в хімії — це основний принцип, який використовується для заповнення електронів на атомних орбіталях будь-якого атома. Ця теорема говорить нам про порядок, у якому електрони заповнюються на атомній орбіталі.
Хто дав принцип Ауфбау?
Принцип Ауфбау був сформульований відомим датським фізиком Нільсом Бором у 1920 році.
Що таке принцип виключення Паулі?
Принцип виключення Паулі стверджує, що в атомі немає двох електронів, які мають усі чотири квантові числа t він же. Принаймні одне з квантових чисел різне для всіх електронів в атомі.
Що таке правило n+l?
Правило n+l — це правило, згідно з яким енергія орбіталі залежить від суми головного квантового числа (n) і азимутального квантового числа (l). це правило називається правилом (n+l).
Які є винятки з принципу Ауфбау?
Винятком із принципу Ауфбау є:
- Електронна конфігурація хрому Cr[24]
- Електронна конфігурація міді Cu[29]
