Атомні орбіталі , які є математичними функціями, описують хвильову поведінку електронів (або електронних пар) в атомі. Атомні орбіталі мають різну форму залежно від їх типу. Різні форми атомних орбіталей описують, що існує або найвища, або нульова ймовірність знаходження електрона навколо ядра в деяких напрямках. Існує чотири типи орбіталей, кожна з яких має різну форму і позначається літерами s, p, d і f. S- і p-орбіталі враховуються, тому що вони найбільш поширені в хімічній і біологічній хімії. Ан s-орбіталь має сферичне ядро в центрі, a р-орбіталь має форму гантелі, а чотири з п'яти г орбіталі мають форму листа конюшини. П’ята d-орбіталь має форму довгої гантелі з бубликом у центрі. Орбіталі атома організовані в шари або електронні оболонки.
Що таке атомні орбіталі?
Атомні орбіталі — це тривимірний простір біля ядра атома, де можливість виявлення електрона максимальна.
Атом, згідно з квантовою атомною моделлю, може мати нескінченну кількість орбіталей. Ці орбіталі можна класифікувати за розміром, формою або орієнтацією. Вужча орбіталь означає кращу ймовірність захопити електрон поблизу ядра. Орбітальна хвильова функція часто відома як математична функція, яка використовується для вираження координат електрона. Імовірність визначення місця розташування електрона представлена квадратом орбітальної хвильової функції. Ця хвильова функція також допомагає створювати діаграми граничних поверхонь.
Орбітальна хвильова функція
The квантова модель атома передбачає, що атом може мати величезну різноманітність орбіталей. Ці орбіталі можна згрупувати відповідно до їх розміру, геометрії або нахилу. Зменшений розмір орбіталі збільшує ймовірність отримання електрона близько до ядра. Математична функція, яка використовується для представлення координат електрона, називається орбітальна хвильова функція . Імовірність виявлення електрона представлена квадратом орбітальної хвильової функції.
Ми також можемо використовувати цю хвильову функцію для створення діаграм граничної поверхні. Ми можемо краще зрозуміти форму орбіталей, використовуючи діаграми граничної поверхні постійної щільності ймовірності для різних орбіталей.
fmovies Індія
Форми атомних орбіталей
Форма атомних орбіталей різна. Тобто розподіли ймовірностей електронів, які вони описують навколо ядра, різні. Той факт, що електрони на різних орбіталях, ймовірно, розташовані в різних областях навколо батьківського ядра і, отже, відчувають тяжіння останнього з різною силою, є однією з причин, чому орбіталі мають різну енергію. Дивно, що всі орбіталі в даній оболонці атома водню мають однакову енергію, але мають різні форми. Це пов'язано з усуненням різних енергетичних внесків.
Але як тільки з'являється другий електрон, виродження зникає.
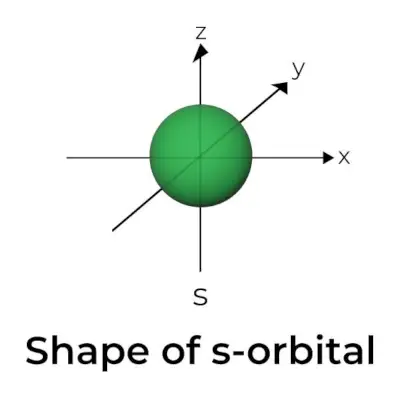
Форма s-орбіталі
- Діаграма s-орбітальної граничної поверхні нагадує сферу з ядром у центрі, яку можна показати у двох вимірах у вигляді кола.
- s-орбіталі є сферично симетричними, що означає, що ймовірність знайти електрон на даній відстані однакова в усіх напрямках.
- Також показано, що розмір s-орбіталі збільшується зі збільшенням значення первинного квантового числа (n); отже, 4s> 3s> 2s> 1s.
- Вузлова точка - це місце, де немає шансів знайти електрон. Вузли класифікуються на два типи: радіальні вузли та кутові вузли. Відстань від ядра обчислюється радіальними вузлами, тоді як орієнтація визначається кутовими вузлами.
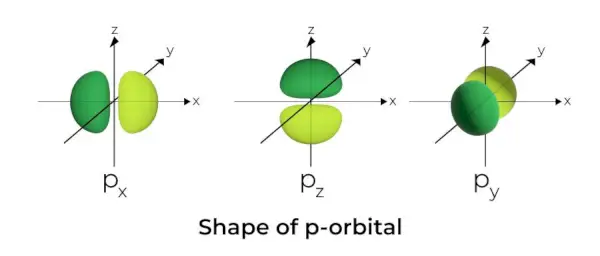
Форма р-орбіталі
- Р-орбіталі сформовані як гантелі.
- Р-орбітальний вузол розташований у центрі ядра.
- Через наявність трьох орбіталей p-орбіталь може займати максимум шість електронів.
- Кожна p-орбіталь складається з двох частин, відомих як пелюстки, які розташовані по обидва боки від площини, яка проходить через ядро.
- Кожна р-орбіталь має частини, відомі як пелюстки, по обидві сторони від площини, яка проходить через ядро. У площині, де перетинаються дві пелюстки, ймовірність виявлення електрона дорівнює нулю.
- Три орбіталі відомі як вироджені орбіталі, оскільки вони мають однаковий розмір, форму та енергію.
- Єдина відмінність орбіталей полягає в орієнтації часток. Оскільки пелюстки орієнтовані вздовж осі x, y або z, вони називаються 2px, 2pyі 2pz. Для розрахунку кількості вузлів використовується формула n –2.
- Подібно до s-орбіталей, розмір і енергія p-орбіталей зростають зі збільшенням первинного квантового числа (4p> 3p> 2p).
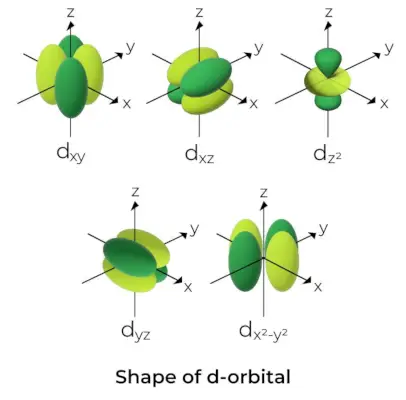
Форма d-орбіталі
- Для d-орбіталей магнітне орбітальне квантове число подається як (-2,-1,0, 1,2). У результаті можна стверджувати, що d-орбіталей п'ять.
- Ці орбіталі позначаються символами dxy, дyz, дxz, дx2-і2, і dс2.
- Форми перших чотирьох d-орбіталей схожі між собою, чим відрізняється від dс2орбіталь, але енергія всіх п’яти d-орбіталей однакова.
Форма f-орбіталі
- Форма f-орбіталі розсіяна. Оскільки значення l=3 для f-орбіталі, мінімальне значення первинного квантового числа n дорівнює 4.
- Еквівалентні значення ml для f-орбіталі (-3,–2, –1, 0, +1, +2, +3).
- У результаті існує сім f-орбіталей для l = 3.

як змінити рядок на int
Вироджені орбіталі
Вироджені орбіталі — орбіталі з однаковою енергією. Ці орбіталі є різними (вони можуть бути по-різному орієнтовані в просторі навколо атомне ядро ), але вони мають однакову енергію. При наявності зовнішнього поля виродження р-орбіталі не змінюється; однак виродження f- і d-орбіталей можна порушити, прикладаючи до системи зовнішнє поле (електричне або магнітне).
Кілька орбіталей матимуть вищу енергію, а інші – меншу. У системі більше не буде виродження. Наприклад, d-орбіталі складаються з п’яти вироджених орбіталей, які мають однакову енергію.
Детальніше:
- Теорія молекулярних орбіталей
- Заповнення орбіталі в атомі
- Гібридизація
Поширені запитання про форми атомних орбіталей
Питання 1: Як працюють орбіталі?
відповідь:
Атомна орбіталь — це математичний вираз, який виражає хвилеподібну поведінку одного електрона або пари електронів в атомі в атомній теорії та квантовій механіці. Кожна орбіталь займе максимум два електрони, кожен зі своїм спіном.
Запитання 2: Що таке вузлова площина?
особливості java
відповідь:
Площина, де ймовірність знаходження електрона незначна або дорівнює нулю, називається вузловою площиною.
Запитання 3: Скільки існує орбіталей?
відповідь:
Оскільки підрівень s має лише одну орбіталь, можуть бути присутні лише два електрони. Оскільки p-підрівень складається з трьох орбіталей, може бути присутнім максимум шість електронів. Оскільки підрівень d складається з 5 орбіталей, може бути присутнім максимум 10 електронів. І кожен із чотирьох підрівнів має сім орбіталей, які можуть утримувати максимум 14 електронів.
Запитання 4: Які орбіталі мають найбільшу енергію?
верхній індекс в ілюстраторі
відповідь:
порівняти рядки java
Орбітальна 1s має найбільшу енергію. Енергія електрона — це кількість енергії, необхідна для того, щоб вийти з електричної бульбашки атома.
Запитання 5: Яка різниця між оболонкою та орбіталлю?
відповідь:
В атомі оболонка — це сукупність підоболонок однієї квантової теорії чисел, n. Кожна орбіталь має по два електрони, і електрони на одній орбіталі мають однакове визначення розміру, розміру кутового моменту та магнітного квантового числа.
Запитання 6: Що таке сигма-і пі-зв'язок?
відповідь:
Перекривання атомних орбіталей створює сигма- та пі-зв’язки. Сигма-зв’язки утворюються шляхом перекриття атомних орбітальних часток, тоді як Пі-зв’язки утворюються, коли одна атомна орбітальна частка перекриває іншу.
