Основа — хімічна сполука, яка складається з ОН–іонів і приймає протони. Основи в хімії — це сполуки, які забарвлюють червоний лакмус у синій колір, і при взаємодії з кислотою вони нейтралізують реакцію з утворенням солі та води. Значення рН основи більше 7. Основи гіркі на смак і слизькі на дотик. Основи, розчинні у воді, називають лугами. Прикладами основ є оксиди металів, гідроксиди металів тощо. Мило є прикладом основи, яку ми використовуємо в повсякденному житті. У цій статті ми детально дізнаємося про визначення, властивості та хімічні реакції основ.

Базове визначення
Основа визначається як хімічна сполука, значення рН якої перевищує 7, приймає протон, нейтралізує кислоту та перетворює червоний лакмус на синій. Вони зазвичай вивільняють OH–іон при дисоціації. Приклади включають NaOH, NaHCO3,і т. д. Нижче наведено деякі загальні характеристики, які показує база:
- Вони мають гіркий смак
- Вони слизькі на дотик
- Вони забарвлюються в синій червоний лакмус
- Вони звільняють OH–іон при розчиненні у воді
- Вони проводять електрику у формі розчину
Основи є одними з найважливіших хімічних сполук, які використовуються в повсякденному житті. Основи використовуються як антациди для контролю кислотності та в зубній пасті для нейтралізації дії бактерій, які виробляють кислоту в нашому роті, і запобігають деградації емалі та карієсу. Вони також використовуються як розпушувач, харчова сода та пральний порошок.
База Льюїса
Основи Льюїса - це сполуки, які мають електронну пару, і вони можуть віддавати її сполукам, які мають дефіцит електронних пар. Основи Льюїса є нуклеофільними за своєю природою, тобто вони люблять ядра, що означає, що вони атакуватимуть позитивно заряджений центр своїми електронними парами. Приклади основи Льюїса включають аміак, оскільки в аміаку (NH3) центральний атом Нітрогену має 5 електронів, з яких 3 використовуються для створення зв’язків з 3 атомами Гідрогену, а одна пара електронів залишається з атомом N, утворюючи NH3база Льюїса.
База Арреніус
Згідно з концепцією Арреніуса, основи — це сполуки, які при розчиненні у воді вивільняють гідроксильні іони та збільшують концентрацію гідроксильних іонів у водному розчині. Наприклад, коли KOH розчиняється у воді, він дає OH–іон і тим самим збільшити концентрацію ОН–у воді.
База Бренстед
Концепція основи Бренстеда є вдосконаленою версією концепції Арреніуса, яка стверджує, що основи є сполуками, які приймають H+іон або протон з утворенням їх сполученої кислоти. Наприклад, Cl–є базою, яка приймає H+з утворенням HCl як його сполученої кислоти.
Типи баз
Основи можна класифікувати на основі кислотності, концентрації та здатності до іонізації. Класифікація наведена нижче
Типи основ за кислотністю
Кислотність основи відноситься до кількості замінних гідроксильних груп, присутніх в одній молекулі основи. Залежно від кислотності основи поділяють на три категорії:
- Однокислотна основа
- Діацидна основа
- Трикислотна основа
монокислотні: Однокислотні основи — це основи, які містять лише один замінний гідроксильний іон і взаємодіють лише з одним іоном водню. До однокислотних основ належать NaOH, KOH та ін.
двокислотний: Двокислотна основа — основа з двома замінними гідроксильними іонами, які взаємодіють з двома іонами водню. Ca(OH)2, Mg(OH)2, та інші двокислотні основи є прикладами.
Трикислотний: Трикислотна основа — це тип основи, яка містить три замінні гідроксильні іони та три іони водню. Трикислотні основи включають Al(OH)3, Fe(OH)3, та інші.
Типи основ за їх концентрацією у водному розчині
Концентрація відноситься до кількості основи, присутньої у водному розчині. Залежно від концентрації у водному розчині основи діляться на дві категорії:
- Концентрована основа
- Розбавлена основа
Концентрована основа: Концентровані основи - це ті, в яких кількість основи велика порівняно з розчинником. Наприклад, концентрований розчин NaOH.
Розведена основа: Ці типи основ мають нижчу концентрацію основи у своєму водному розчині. Розведення - це процес зменшення відсоткового вмісту розчиненої речовини шляхом додавання більшої кількості розчинника. Наприклад, розбавте NaOH, розведіть KOH тощо.
Типи основ за ступенем іонізації
Ступінь іонізації означає здатність хімічної сполуки вивільняти іон, що входить до її складу, при розчиненні у воді. У випадку основи ступінь іонізації відноситься до здатності основи вивільняти ОН–іонів, коли вони розчинені у воді. За ступенем іонізації основи поділяються на два види:
- Сильна база
- Слабка база
Сильна основа: Сильні основи — це основи, які повністю дисоціюють і вивільняють іон OH- при розчиненні у воді. Деякі приклади сильних основ включають NaOH, KOH тощо.
Слабка основа: Основи, які не піддаються повній дисоціації і вивільняють лише частину іонів OH-, називаються слабкими основами. Приклади слабких основ включають Al(OH)3,Cu(OH)2,тощо
Вивчайте більше, Сильні і слабкі основи
Властивості основ
Як ми знаємо, основи — це хімічні сполуки, які мають іон ОН-, червоний лакмус стає синім тощо. У цьому розділі ми дізнаємося про фізичні та хімічні властивості основ разом із деякими короткими відомостями про їхні загальні властивості.
Загальні властивості основи
Нижче наведено загальні властивості Баз:
- Гідроксид-іон (OH–) викидається у воду основами. Чим сильнішою стає основа, чим більше виділяється іонів.
- Основи реагують з кислотою з утворенням солі Кислоти реагують з основами. Ця реакція основи з кислотою називається реакцією нейтралізації.
- Бази перетворюють червоний лакмус на синій.
- Структура білка може бути змінена основами. Бази мають цю якість, що робить їх гладкими. Мило — це основа, яка стає неймовірно слизькою на шкірі, коли намокає. Через свою здатність змінювати структуру білків деякі потужні основи надзвичайно небезпечні.
Фізичні властивості основ
Основи на смак Гіркі: Основи гіркі на смак. Через його гіркоту ми маємо лише кілька лужних продуктів. Є лише кілька лужних харчових матеріалів. Основи потрібно пробувати з більшою обережністю, ніж кислоти.
Бази слизькі на дотик: Під час дотику бази слизькі. Наприклад, мило.
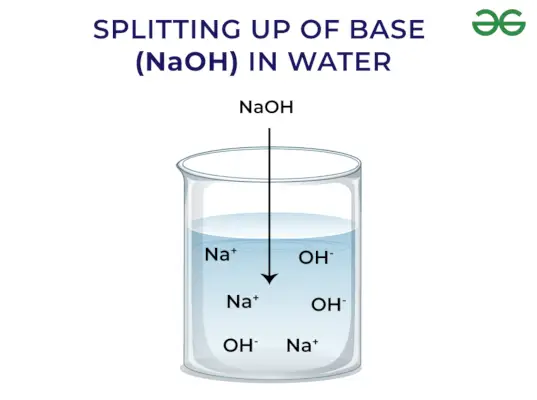
Основи виділяють ОН – Іон: Коли основи розчиняються у воді, вони виділяють гідроксильний іон (OH–). Залежно від здатності вивільняти гідроксильні іони їх поділяють на сильні та слабкі.
Основи нейтралізують кислоти: Коли основи реагують з кислотами, вони нейтралізують одна одну і утворюють сіль і воду. Ця реакція називається Реакція нейтралізації . Скажімо, у нас є кислота HY і основа «XOH», тоді утворена сіль буде «XY». Рівняння цієї реакції можна подати як HY + XOH → HOH + XY.
рядок списку java
Основи денатурують білок: Денатурація білка означає руйнування стабільності та структури білка. Це робить використання основи шкідливим для людини, оскільки людська шкіра та волосся складаються з білка, а сильні луги, такі як гідроксид натрію або калію, які також називають лугом, шкідливо впливають на шкіру людини.
Основи перетворюють червоний лакмус на синій: Коли підстави стикаються з червоним лакмусом, вони стають синіми. Однак слід зазначити, що такої зміни не можна спостерігати, коли ми намагаємося прореагувати на суху основу з червоним лакмусовим папірцем. Лакмусовий папірець є одним із найстаріших методів тестування. Однак існують і інші індикатори, такі як фенолфталеїн
Основи проводять електрику: Коли основи перебувають у формі розчину, вони мають рухомий іон OH-, отже, можуть проводити електрику.
Хімічні властивості основ
- Реакція основи з металами: Коли луг (основа) реагує з металом, утворюється сіль і водень.
Луг + Метал → Сіль + Гідроген
приклади:
- Коли гідроксид натрію взаємодіє з металевим алюмінієм, утворюється алюмінат натрію та газоподібний водень.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Коли гідроксид натрію взаємодіє з металевим цинком, утворюється газоподібний водень і цинкат натрію.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Реакція оксидів неметалів з основою: Сіль і вода утворюються при взаємодії оксидів неметалів з основою.
Неметалічний оксид + основа → сіль + вода
Коли гідроксид кальцію реагує основа з вуглекислим газом, утворюється карбонат кальцію та вода.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 О
- Реакція лугів/основ із солями амонію: Аміак утворюється при взаємодії лугів з солями амонію.
Луг + Амонійна сіль → Сіль + Вода + Аміак
Коли гідроксид кальцію реагує з хлоридом амонію, утворюється хлорид кальцію вода та аміак.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Приклади баз
Основи, як правило, це оксид металу, гідроксид металу, гідрогенкарбонат металу, карбонат металу тощо. Давайте подивимося деякі приклади основ із їх застосуванням у формі таблиці:
| Бази | Додатки |
|---|---|
| Гідроксид калію KOH | Використовується в лужних батареях |
| Їдкий натр NaOH | Використовується у виробництві мила та миючих засобів |
| Гідроксид магнію Mg(OH) 2 | Використовують як антациди |
| Бікарбонат натрію NaHCO 3 | Використовується як харчова сода |
| Карбонат натрію вже 2 CO 3 | Використовується як пральна сода |
| Аміак NH 3 | Використовується у виробництві миючих та фармацевтичних засобів |
| Гідроксид кальцію Ca(OH) 2 | Використовується при білому пранні |
Використання баз
Існують різні випадки використання бази, деякі з них:
- Гідроксид натрію використовують у виробництві мила та паперу. Гідроксид натрію (NaOH) також використовується у виробництві віскози.
- Відбілювач виготовляється з Ca(OH)2, широко відомий як гашене вапно або гідроксид кальцію.
- Гідроксид кальцію використовують для створення сухих малярно-оздоблювальних сумішей.
- Гідроксид магнію, широко відомий як магнезіальне молоко, є проносним засобом, який широко використовується. Він також використовується як антацид, оскільки він знижує надлишкову кислотність у шлунку людини.
- У лабораторіях гідроксид амонію є критичним реагентом.
- Гашене вапно можна використовувати для нейтралізації надлишкової кислотності ґрунтів.
Детальніше
- Кислота, основа і сіль
- Сила кислоти
- Іонізація кислоти та основи
Поширені запитання про основи хімії
1. Що таке бази?
- Основні сполуки мають гіркуватий смак.
- Текстура більшості основ мильна.
- При перевірці на лакмусовому папірці він перетворює червоний лакмусовий папірець у синій у більшості випадків.
- У розчині основні сполуки також проводять електричний струм.
- При розчиненні основних сполук у воді виділяються іони ОН-.
2. Які функції основ?
Вдома ми використовуємо основи як миючі засоби та антациди. Мило, луг (який використовується в засобах для чищення духовок), магнезіальне молочко та тумби – все це приклади популярних домашніх основ. Кожен з них має pH більше семи, може споживати вільний водень і нейтралізувати кислоти.
3. Яка найважливіша відмінність між кислотою та основою?
Кислоти і основи є два типи корозійних хімікатів. Кислотні матеріали мають значення pH від 0 до 7, тоді як основи мають значення pH від 7 до 14. Кислоти є іонними хімічними речовинами, які розкладаються у воді, створюючи іон водню (H+), тоді як основи дисоціюють з утворенням іонів OH-.
4. Які фізичні властивості основ?
- Вони мають гіркий смак.
- Їхні водні розчини мають мильну властивість.
- Вони змінюють колір лакмусового папірця з червоного на синій.
- Їхні водні розчини є електропровідними.
- З виділенням газоподібного водню основи реагують з металами, утворюючи сіль.
5. Що станеться, коли кальцій гідроксид реагує з амоній хлоридом?
Коли гідроксид кальцію реагує з хлоридом амонію, утворюється хлорид кальцію вода та аміак.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Що станеться, коли натрій гідроксид прореагує з металевим цинком?
Коли гідроксид натрію взаємодіє з металевим цинком, утворюється газоподібний водень і цинкат натрію.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Що таке база Льюїса?
Основа Льюїса - це сполуки, які віддають пару електронів електронно-дефіцитній сполукі. Приклад включає NH3.
8. З чого виготовляють основи?
Основи зазвичай складаються з ОН–іон. Окрім цих оксидів металів, карбонати та гідрокарбонати також є основами.
9. Що таке луги?
Основи, розчинні у воді, називають лугами. Прикладом є гідроксид натрію NaOH.
10. Що таке сильна та слабка основа?
Основи, які повністю дисоціюють з утворенням ОН–іони при розчиненні у воді називаються сильною основою. Приклади включають NaOH. Слабкі основи - це ті, які не дисоціюють повністю з утворенням ОН–іон називають слабкою основою. Приклади слабких основ включають гідроксид амонію.
