Поняття про гібридизація визначається як процес поєднання двох атомних орбіталей для створення нового типу гібридизованих орбіталей. Це перемішування зазвичай призводить до утворення гібридних орбіталей з абсолютно різними енергіями, формами тощо. Гібридизація в основному здійснюється атомними орбіталями однакового рівня енергії. Проте в цьому процесі можуть брати участь як повністю, так і наполовину заповнені орбіталі, якщо їх енергії рівні. Концепція гібридизації є розширенням теорії валентного зв’язку, яка допомагає нам зрозуміти утворення зв’язку, енергію зв’язку та довжину зв’язку.
Що таке гібридизація?
Коли дві атомні орбіталі об’єднуються, утворюючи гібридну орбіталь у молекулі, енергія орбіталей окремих атомів перерозподіляється, щоб отримати орбіталі з еквівалентною енергією. Це відомо як гібридизація.
Атомні орбіталі з порівнянними енергіями змішуються разом під час процесу гібридизації, який здебільшого включає злиття двох орбіталей або двох 'p'-орбіталей або змішування 's'-орбіталі з 'p'-орбіталлю, а також з 's' орбіталь з орбіталлю «d».
Гібридні орбіталі це нові орбіталі, що утворюються в результаті цього процесу. Що більш важливо, гібридні орбіталі можна використовувати для пояснення властивостей атомного зв’язку та молекулярної геометрії. Карбон, наприклад, утворює чотири одинарні зв’язки, в яких s-орбіталь валентної оболонки поєднується з трьома p-орбіталями валентної оболонки. Ця комбінація генерує чотири еквівалентні sp3сумішей. Вони будуть розташовані у формі тетраедра навколо вуглецю, який зв’язаний із чотирма різними атомами.
Етапи визначення типу гібридизації
Щоб зрозуміти тип гібридизації в атомі чи іоні, необхідно дотримуватися таких правил.
найкрасивіша посмішка
- Спочатку визначте загальну кількість валентних електронів, що містяться в атомі чи іоні.
- Потім підрахуйте кількість неподілених пар, приєднаних до цього атома чи іона.
- Тепер необхідну кількість орбіталей можна розрахувати, додавши кількість дуплексів або октетів і кількість неподілених пар електронів.
- Слід зазначити, що геометрія орбіталей в атомах або іонах відрізняється, коли немає неподіленої пари електронів.
Особливості гібридизації
- Гібридизація відбувається між атомними орбіталями з однаковими енергіями.
- Кількість утворених гібридних орбіталей дорівнює кількості атомних орбіталей, які змішуються.
- Не обов'язково, щоб усі наполовину заповнені орбіталі брали участь у гібридизації. Навіть орбіталі, які повністю заповнені, але мають дещо різну енергію, можуть брати участь.
- Гібридизація відбувається лише під час утворення зв’язку, а не в окремому атомі газу.
- Якщо гібридизація молекули відома, форму молекули можна передбачити.
- Велика пелюстка гібридної орбіталі завжди позитивна, тоді як менша пелюстка на протилежному боці завжди негативна.
Типи гібридизації
Гібридизацію можна класифікувати як sp3, sp2, зр., зр3d, sp3d2, або зр3d3на основі типів орбіталей, які беруть участь у змішуванні.
Ігри imessage на андроїд
sp Гібридизація
Це відбувається, коли одна s та одна p-орбіталі в основній оболонці атома поєднуються, утворюючи дві нові еквівалентні орбіталі. Новоутворені орбіталі відомі як sp-гібридизовані орбіталі. Він виробляє лінійні молекули під кутом 180°. Це передбачає поєднання своєї орбіталі та однієї «p»-орбіталі однакової енергії для отримання нової гібридної орбіталі, відомої як sp-гібридизована орбіталь.
- Це також відоме як діагональна гібридизація.
- Кожна sp-гібридизована орбіталь містить однакову кількість символів s і p.
- Усі сполуки берилію, наприклад BeF2, Добре2, і BeCl2, є приклади.

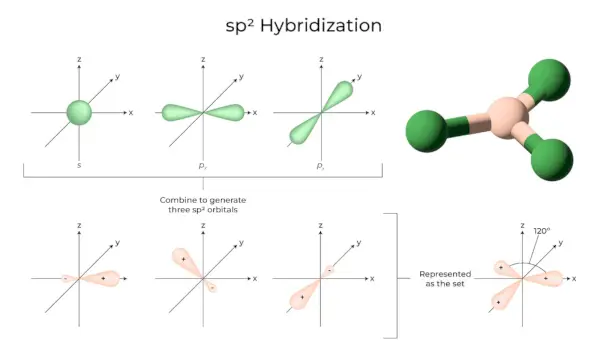
зр2Гібридизація
Це відбувається, коли одна s і дві p-орбіталі оболонки одного атома об’єднуються, утворюючи три еквівалентні орбіталі. Новоутворені орбіталі відомі як sp2гібридні орбіталі. Він також відомий як тригональна гібридизація. Це передбачає об’єднання своєї орбіталі з двома «p» орбіталями однакової енергії для створення нової гібридної орбіталі, відомої як sp2. Суміш тригональної симетрії s- і p-орбіталей зберігається під кутом 120 градусів. Усі три гібридні орбіталі залишаються в одній площині й утворюють одна з одною кут 120°.
- Кожна утворена гібридна орбіталь має 33,33 % і 66,66 % характер «p».
- Молекули з трикутною плоскою формою мають центральний атом, який пов’язаний з трьома іншими атомами і є sp2гібридизовані. Прикладами є сполуки бору.
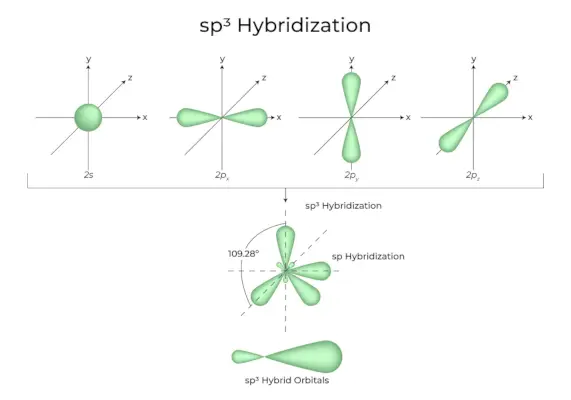
зр3Гібридизація
Коли одна «s»-орбіталь і три «p»-орбіталі з однієї оболонки атома об’єднуються, утворюючи чотири нові еквівалентні орбіталі, гібридизація відома як тетраедральна гібридизація або sp.3. Новоутворені орбіталі відомі як sp3гібридні орбіталі. Вони загострені в чотирьох кутах правильного тетраедра та утворюють один з одним кут 109°28′.
- Сп3гібридні орбіталі утворюють кут 109,28 градусів.
- Кожна гібридна орбіталь має 25% s характер і 75% p характер.
- Етан і метан є двома прикладами.
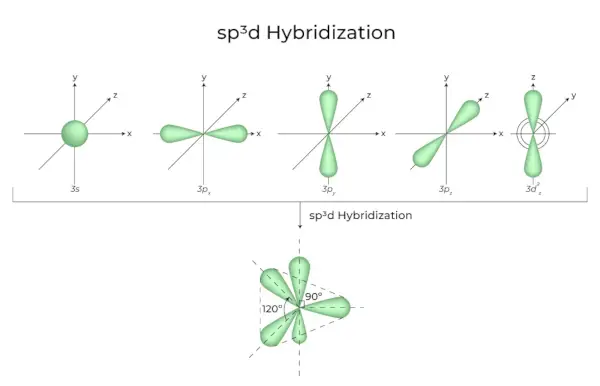
зр3г Гібридизація
Змішування 1s-орбіталей, 3p-орбіталей і 1d-орбіталей призводить до 5 sp3d-гібридизованих орбіталей однакової енергії. Їх геометрія тригонально-біпірамідальна. Комбінація s, p і d-орбіталей призводить до тригональної біпірамідальної симетрії. Екваторіальні орбіталі — це три гібридні орбіталі, які орієнтовані одна відносно одної під кутом 120° і лежать у горизонтальній площині.
- Решта дві орбіталі, відомі як аксіальні орбіталі, знаходяться у вертикальній площині під кутом 90 градусів до екваторіальних орбіталей.
- Гібридизація в пентахлориді фосфору, наприклад (PCl5).
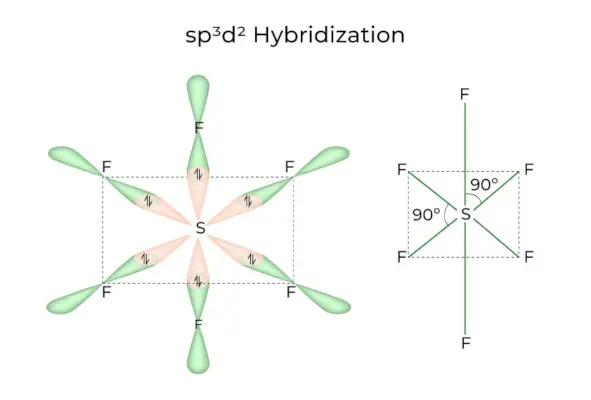
зр3d2 Гібридизація
Коли 1s, 3p і 2d орбіталі об’єднуються, утворюючи 6 однакових sp3d2гібридних орбіталей, гібридизація називається sp3d2Гібридизація. Ці сім орбіталей вказують на кути октаедра. Вони нахилені один до одного під кутом 90 градусів.
альтернатива xampp
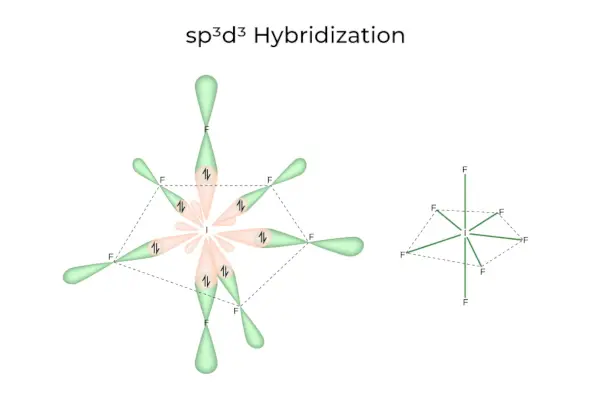
зр3d3Гібридизація
Він має 1s, 3p і 3d орбіталі, які об’єднуються, утворюючи 7 однакових sp3d3гібридні орбіталі. Ці сім орбіталей вказують на кути п'ятикутної біпіраміди. напр. ЯКЩО6.
Форми гібридизації
- Лінійний: sp-гібридизація спричинена взаємодією двоелектронних груп; орбітальний кут дорівнює 180°. Тригональний планар: задіяні три групи електронів, що призводить до sp2гібридизація; орбіталі віддалені одна від одної на 120°. Тетраедр: задіяні чотири електронні групи, що призводить до sp3гібридизація; орбітальний кут 109,5°. Тригональний біпірамідний: задіяно п’ять електронних груп, що призводить до sp3г гібридизація; орбітальні кути дорівнюють 90° і 120°. Октаедр: задіяно шість електронних груп, що призводить до sp3d2гібридизація; орбіталі розташовані на 90° одна від одної.
Поширені запитання на Гібридизація
Запитання 1: яка гібридна орбіталь є більш електронегативною серед sp, sp2 та sp3?
відповідь:
Відсоток символу s в sp, sp2, і sp3гібридизованого вуглецю становить 50%, 33,33% і 25% відповідно. Через сферичну форму s-орбіталі вона рівномірно притягується ядром з усіх боків. У результаті гібридна орбіталь s-характеру буде ближче до ядра і, отже, більш електронегативна. Як результат, sp-гібридизований вуглець є найбільш електронегативним.
Запитання 2: Що таке гібридні орбіталі?
відповідь:
java перетворює char на int
Гібридні орбіталі утворюються шляхом поєднання стандартних атомних орбіталей і в результаті утворення нових атомних орбіталей.
Запитання 3: Які є п'ять форм гібридизації?
відповідь:
Лінійна, тригональна, плоска, тетраедральна, тригональна, біпірамідальна та октаедрачна є п’ятьма основними формами гібридизації.
Питання 4: Чому молекула аміду виглядає як sp3гібридизований, але є sp2?
b+ дерева
відповідь:
Якщо атом або оточений двома або більше р-орбіталями, або має самотню пару, здатну перескочити на р-орбіталь, загальний процес гібридизації зміниться. У результаті у випадку молекули аміду неподілена пара входить у р-орбіталь, у результаті чого утворюються три суміжні паралельні р-орбіталі.
Запитання 5: Що таке правило Бента?
відповідь:
Центральний атом, з’єднаний з численними групами в молекулі, буде гібридизуватися, в результаті чого орбіталі з більшим s-характером будуть спрямовані до електропозитивних груп, а орбіталі з більшим p-характером – до електронегативних груп.
